היסוד: חנקן (N).
 |
מידע כללי: |
החנקן (N) הוא גז חסר צבע טעם וריח. החנקן אינו בוער ואף לא מסייע לחומרים אחרים לבעור. מרכיב 78% מנפח האטמוספירה וכתרכובת עם יסודות נוספים הוא שכיח בכמה מרבצים מינרלים. החנקן מרכיב חשוב בחלבונים, בחומצות גרעין ובחומרי טבע רבים נוספים. סימולו של החנקן- N, כשמו בלע"ז Nitrogen, שפירושו – יוצר מלחים.
|
מס' אטומי |
מסה אטומית |
נקודת התכה |
נקודת רתיחה |
מצב צבירה בטמפ' החדר |
צפיפות |
| 7 |
14 |
210°C- |
195.8°C- |
גז |
1.25 גר' לליטר |
 |
היסטוריה: |
במאה ה- 18 היה ידוע כי האוויר מכיל לכל הפחות 2 גזים, כאשר אחד מהם הוא זה שמאפשר את קיום החיים ובנוסף עוזר לבעירה, ואחד שלא נחוץ לנו ולא עוזר לחומרים לבעור. בזה התכוונו לחנקן. החנקן התגלה ע"י דניאל רתפורד בסקוטלנד, בשנת 1772, אשר קרא לחנקן " גז מזיק". בגלל שהחנקן נראה לאנשים באותו זמן יסוד אדיש ולא פעיל לבואזיה קרא לו Azote , שפירושו - "חסר חיים". אולם כיום אנו יודעים כי החנקן אינו כזה כלל וכלל. החנקן בתרכובותיו חיוני כחומר מדשן, כחומר נפץ וכמרכיב במזון.
 |
שכיחות: |
החנקן מופיע בטבע בצורת מולקולה דו אטומית – N2, ובצורתו זו הוא מרכיב 78% מנפח האטמוספירה. לחנקן יש 2 איזוטופים: השכיח הוא 14N והנדיר הוא 15N (רק 0.3%!).
 |
דוגמאות לתרכובות החנקן: |
- חנקן דו-חמצני ( NO2) – זהו גז חום שמפיקים אותו באמצעות פירוק N2O4. ניתן לפרקו לחנקן חד חמצני (NO) ולחמצן. החנקן הדו חמצני משמש כמחמצן ( דלק לטילים) וגם לתגובות ניטרציה ( ניטרציה היא הצמדת החנקן הדו חמצני לתרכובת אורגנית).
- דו-חנקן חמצני (N2O) – דו חנקן חמצני, או בשמו הנוסף תחמוצת חנקית, הוא גז הצחוק המוכר לנו. גז זה הוא חסר צבע ובעל ריח וטעם מתקתקים, הנמס במים בצורה ניכרת. במעבדה ובתעשייה מפיקים אותו באמצעות חימום עדין של אמון ניטרטי (NH4NO3), שמתפרק לדו-חנקן חמצני ולמים. במרפאות שיניים וברפואה ככלל משתמשים בו כחומר מרדים. שמו הנוסף, "גז הצחוק", ניתן לו משום שהוא גורם להרגשת התרוממות לאדם ששואף אותו.
- חנקן חד חמצני (NO) - בניגוד לחנקן הדו חמצני זהו גז חסר צבע, לא מתמוסס במים אך מתמוסס בתמיסה המכילה יוני ברזל. חומר זה מתקבל ע"י תגובת חומצה חנקתית על שבבי נחושת. בתעשייה הוא מופק ע"י חמצון קטליטי של אמוניה, או ע"י התרכבות חנקן ביחד עם חמצן בתוך קשת חשמלית. החנקן החד חמצני מתפרק רק בטמפ' של 1000°C ומעלה והא היציב ביותר בחימום מכל שאר תחמוצות החנקן. אם אמרנו שאת החנקן הדו חמצני ניתן לפרק לחנקן חד חמצני וחמצן הרי שגם ההפך יכול לקרות, כלומר: חנקן חד חמצני המתקשר עם חמצן יוצר חנקן דו חמצני. ה- NO מסייע בתקשורת של תאים עצביים ויש לו קשר למחלות מוח שונות.
- אמוניה (NH3) – גז חסר צבע אך בעל ריח חזק וחריף. כמויות גדולות שלו עשויות לגרום להרעלה, אך ניתן להשתמש בו בכמויות קטנות כדי לעורר אדם שהתעלף. האוויר מכיל כמות קטנה של אמוניה, שמגיעה מצמחים ומבע"ח שנרקבו. כמויות זעירות של אמוניה נמצאות לעיתים במי גשם. הראשון שהפיק את הגז הטהור היה הכימאי האנגלי ג'וזף פריסטלי, והוא קרא לגז "אוויר אלקלי".
 |
שימושי החנקן: |
- לדישון וזיבול – מאחר והחנקן חשוב לחייהם של בעלי החיים משתמשים בחנקן לדישון, כאשר החנקן לדישון מבוסס על נתרן חנקתי. זהו דישון חנקני, כלומר העשרת הקרקע בחנקן הדרוש לצמחים.
- ליצירת אמוניה – משתמשים בחנקן בתהליך הפקתה של האמוניה, וזהו אחד מהשימושים החשובים ביותר של החנקן, מאחר והאמוניה משמשת הן לדישון (כמו החנקן), והן להפקת חומצה חנקתית.
- כמקרר - החנקן משמש לקירור המזון גם בתהליך הפקתו של המזון וגם בתהליך ההובלה של המזון מהמפעל לחנויות.
- ברפואה וברפואת שיניים – הגז דו-חנקן חמצני, המורכב מ- 2 אטומי חנקן ואטום חמצן, משמש כגז מרדים ברפואה הכללית ובמרפאות השיניים.
- בתעשיית הנפט – חנקן נוזלי משמש את תעשיית הנפט כדי ליצור לחץ בקידוחי הנפט, ובאמצעות הלחץ להכריח את הנפט הגולמי לפרוץ החוצה.
- בתעשיית האלקטרוניקה – בתעשיית האלקטרוניקה משתמשים בחנקן גזי בתור אמצעי כיסוי בתהליך ההפקה של רכיבים כמו טרנזיסטור, דיודה (רכיב חשמלי המעביר זרם חשמלי בכיוון אחד בלבד ונמצא בשימוש במחשבים ובחשמל).
 |
"כיצד מפיקים אמוניה בתעשייה? ובמה נחוצה לנו האמוניה?" |
הדרך העיקרית שבה מפיקים את גז האמוניה בתעשייה היא בתהליך הנקרא " תהליך האבר". תהליך זה נקרא על שמו של הכימאי היהודי-גרמני פריץ האבר, אשר פיתח את התהליך הזה בימי מלחה"ע ה- 1, כאשר גרמניה נזקקה לתרכובות החנקן על מנת לייצר חומרי נפץ. התהליך שפיתח האבר הקנה לו בשנת 1918 את פרס נובל לכימיה.
"תהליך האבר" מתרחש במס' שלבים:
בשלב הראשון מפיקים את החומרים הנחוצים לנו – חנקן ומימן. את החנקן ניתן להפיק מהאוויר, ואת המימן – מהמים.
בשלב השני מייבשים את שני הגזים, דוחסים אותם ומחממים אותם עד לטמפ' של 500°C.
בשלב השלישי החנקן והמימן מועברים על פני תערובת המכילה אבקת ברזל ומלחים שונים, וכמות מסוימת של חנקן ומימן מתרכבת ונוצר גז האמוניה.
בשלב הרביעי הגזים שלא התרכבו מוחזרים והתהליך מתחיל מחדש.
לאמוניה היו וישנם שימושים חשובים מאד:
- בימי מלחה"ע ה- 1 אוניות קרב העלו מסך עשן באמצעות שחרור גז האמוניה מתוך מכלים של אמוניה נוזלית, וכך עלה בידי האוניות להסתתר מידי הצוללות.
- כאשר אמוניה וחומצות נוגעים אחד בשני נוצרים מלחי אמוניום, שהם חומר יעיל ושימושי. אמוניום כלורי משמש אותנו בהלחמה, ברפואה ובסוללות חשמל. באמוניום חנקתי ניתן להשתמש כדי לייצר חומרי נפץ מסוימים, ולאמוניום הגופרתי יש שימוש חשוב מאד בייצור דשנים.
- לגידול טוב ותקין של צמחים יש צורך בחנקן בקרקע. בקרקע שבה כמות החנקן אינה מספקת ניתן להוסיף חנקן ע"י דישון באמוניום גופרתי, המופק מהאמוניה.
כל אחד מהחומרים הנ"ל נוצרים באמצעות הגבה של אמוניה עם החומצה המתאימה. ניתן למצוא את מלחי האמוניום גם בטבע בקרקעות פוריות, באזורי געש, במי ים ובשרידים של צמחים ובע"ח.
" מחזור החנקן"
מעגל החנקן או מחזור החנקן בטבע הוא הדרך שבה החנקן עובר בין הקרקע, הצמחים ובע"ח וחוזר חלילה.
מעגל החנקן מתואר בתרשים הבא:
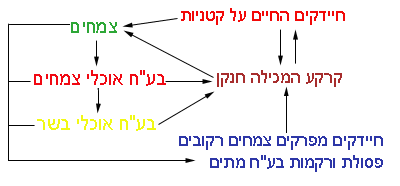
 |
אז מה בעצם מתרחש? |
בע"ח וצמחים אינם יכולים לקלוט את החנקן ישירות מהאוויר. אך הצמחים יכולים לקלוט חנקן מהקרקע. רוב הצמחים קולטים את החנקן מהקרקע בצורת חנקות ואח"כ מייצרים בעזרתם חלבונים.
צמחים מקבוצת הקטניות (אפונה, שעועית) קולטים את החנקן בעזרת חיידקים החיים בפקעיות מיוחדות המצויות על פני השורשים. חיידקים אלו, קולטים חנקן מהאוויר המצוי בקרקע והופכים אותו לחנקות. בד"כ חיידקים אלו מיצרים חנקן בכמות העולה על זו שהצמחים צורכים, ולכן חנקן זה מוחזר לקרקע. הקרקע בה גדלים צמחים ממשפחת הקטניות, מתעשרת בחנקן זמין לצמחים אחרים (זו הסיבה שיש חקלאים המגדלים בחלקה מסוימת גידולי קטניות).
החלבונים, שהצמחים ייצרו מחנקות עוברים אל בע"ח אוכלי צמחים, או אל בע"ח האוכלים את בע"ח הצמחוניים. בסופו של דבר, החנקן הופך מהתרכובות החנקתיות של הקרקע לחנקן חלבוני בגופם של בע"ח. חומרי פסולת חנקתיים, הנפלטים מגופם של בע"ח, הם תרכובות אמוניה, החוזרים לקרקע בתור זבל אורגני. צמחים שלא נאכלו – נובלים, וכאן נכנסים לתמונה חיידקים מיוחדים ההופכים את החלבונים הצמחיים לחנקות המושבות לקרקע.
הפסולת החנקתית מהווה את אחד מגורמי הזיהום העיקריים בעולם המודרני.






